Immediately implantable extracellular matrix-enriched osteoi
雜志名稱:Materials & Design
影響因子:9.417
文獻題目:Immediately implantable extracellular matrix-enriched osteoinductive hydrogel-laden 3D-printed scaffold for promoting vascularized bone regeneration in vivo
第一作者:Jae?Seo Lee,Haram?Nah
通訊作者:Kyu-Sun?Choi,Dong?Nyoung Heo
第一作者單位:Department of Dentistry, Graduate School, Kyung Hee University, 26 Kyungheedae-ro, Dongdaemun-gu, Seoul 02447, Republic of Korea
發表時間:2022-7
本實驗所用產品:RayBio?人類高通量抗體芯片AAH-BLG-2000(同時定量檢測2000種細胞因子、趨化因子、脂肪因子、生長因子、血管生成因子、蛋白酶、可溶性受體、可溶性粘附分子和其他蛋白質)
實驗樣品:細胞外基質
Abstract
為患者重建特異性的支架來修復獨特形狀的骨缺損仍然是近年來組織工程的主要臨床挑戰,當前3D打印支架這種快速生成定制形狀的前景技術備受關注。然而,通常用于3D打印的合成聚合物,如聚己內酯(PCL),缺乏模擬天然細胞外基質功能(支持細胞生長和分化)的生物學能力。本研究研發了一種骨組織工程的富含細胞外基質(ECM)的水凝膠嵌入PCL支架,以人骨髓間充質干細胞來源的基質體(BMTS)作為富集ECM的生物大分子來源,利用人骨髓間充質干細胞(BM-MSCs)進行體外支架。研究中發現該3D混合模型顯示出良好的BM-MSC活性和體外2D和3D培養的成骨活性。通過大鼠顱骨缺損重建模型評估發現,構建的3D混合模型有效地促進了血管化骨再生。因此,基于BMTS的3D混合模型有望成為一種良好的骨組織工程支架,用于骨科應用。
一、研究背景
骨是由嵌入大量膠原束的羥基磷灰石組成的,結合了剛性無機和柔性有機組件,是一種特別的的機械和生物功能的組合,因此,骨重建非常困難,在損傷或組織丟失時骨可能無法保持自然狀態,當損傷區域超過臨界值時,將難以愈合,這是則需要組織工程的支架來支持新生長和誘導組織再生。
3D結構和多功能組件的集成使得工程化組件的制備成為可能。然而,傳統的三維支架大多由非功能性生物材料組成,形成的系統將無法契合生物體環境。因此,骨組織工程復合支架應由硬結構和軟結構組成,并結合復雜的生物聚合物來平衡。
聚己內酯(Polycaprolactone, PCL)多孔支架作為一種固體基板,提供了包含軟支架組件的固體結構框架,由于PCL具有良好的力學性能和模擬復雜解剖結構的能力,已被廣泛應用并利用3D打印技術制備。但相對較差的生物相容性和疏水性,和高溫制作過程使得PCL難以搭載生長因子及活細胞。
水凝膠因其優良的生物相容性和對干細胞]的高負載效率可以彌補PCL的缺陷,填充了由膠原蛋白和纖維蛋白原組成的天然聚合物基水凝膠3D-PCL支架的細胞親和力上升,同時在基質中加入一種血液凝固過程中從纖維蛋白原中提取的纖維蛋白可使基質快速凝固提高機械強度協助組織修復。
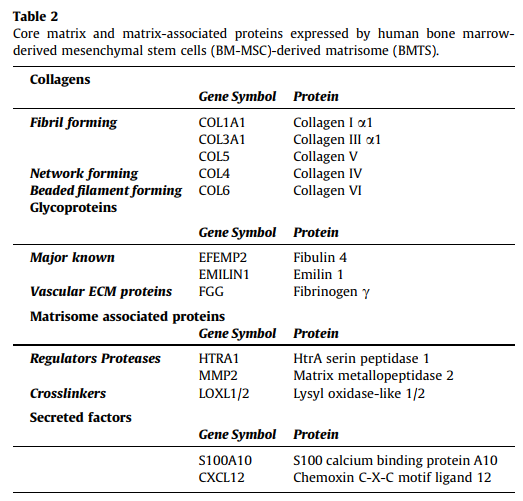
BMTS是從人骨髓間充質干細胞(BM-MSCs)來源的天然ECM中獲得的,含有300多種蛋白和相關細胞因子,相對只含膠原和纖維蛋白原的成分的水凝膠來說,BMTS更適合用于直接供應到受損的骨組織中。
二、結果
2.1 PCL、PCL/CF和PCL/CF/BMTS的特征分析
將CF(collagen/fibrin纖維蛋白)水凝膠和BMTS填充的3D打印PCL支架通過特殊工藝結合形成復合支架。測試結果說明MTS整合到PCL/CF支架中并沒有引起任何物理性能的差異,內部的孔隙相互連接良好水和營養物運輸無礙,BMTS的分子尺寸較小,不影響PCL結構的孔徑大小。
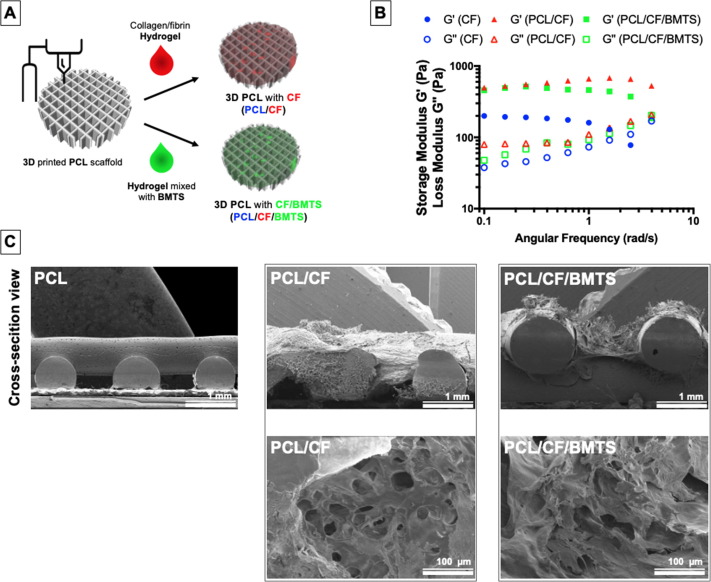

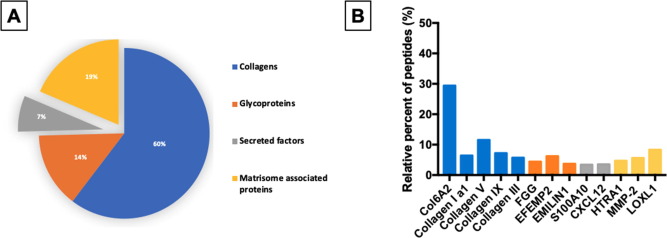
2.1.2高通量抗體芯片篩選最適合用于骨再生的BMTS
用RayBio 2000個蛋白高通量抗體芯片(?AAH-BLG-2000)分析從各個組織中提取出的BMTS中的生物活性因子種類及含量,對比挑選出最適合用于骨再生的BMTS,可以發現從骨骼、脂肪和皮膚等多種組織中提取出的蛋白質種類及含量范圍都相當,但是BM-MSCs中的膠原水平相對較高。
纖維膠原蛋白家族參與組織剛度或強度維持,直接影響機械強度,并且上調參與細胞黏附早期階段的基因,對ECM信號更敏感,可以為為細胞的增殖和分化提供了良好的環境。

2.2 比較不同培養維度下PCL、PCL/CF和PCL/CF/BMTS支架的細胞活力及成骨基因表達能力
為了確定三種3D支架的生物相容性,研究者按照2D(細胞移植在表面)和3D(細胞封裝)的方式對細胞進行孵育。
在兩種結構中,各組BM-MSCs均表現出良好的黏附和增殖能力,而PCL/CF/BMTS組的增殖尤為顯著。
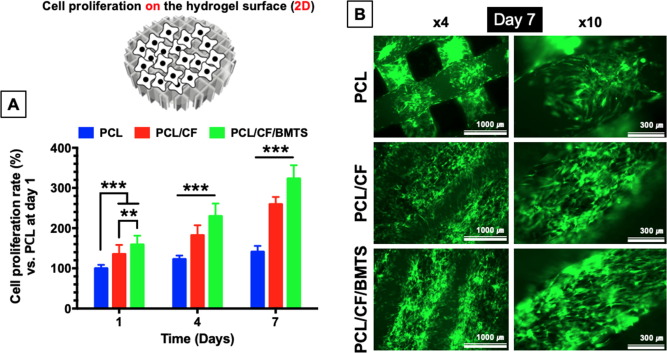

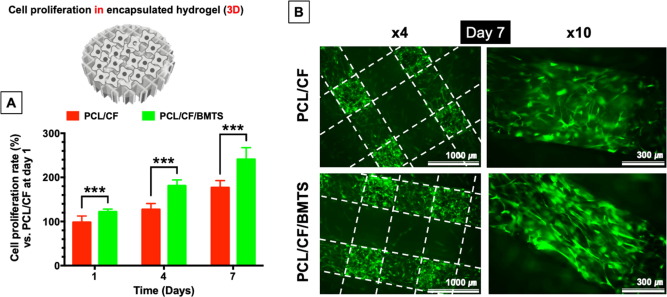

3D結構中BMTS摻入組表現出BM - MSC特異性成纖維細胞樣形態,顯著提高細胞黏附的程度,其中的膠原和糖蛋白在細胞黏合及與ECM結合中也起著關鍵作用。
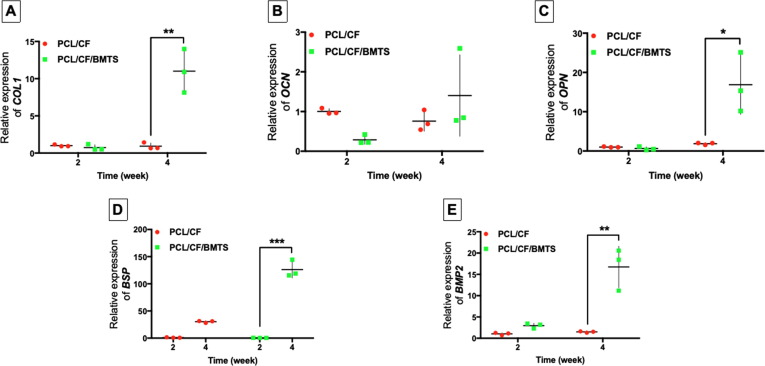
qRT-PCR分析了骨標志物如膠原蛋白1 (COL1),骨鈣素(OCN),骨橋蛋白(OPN),骨涎蛋白(BSP)和骨形態發生蛋白2 (BMP2)的表達發現表達水平較高,其表達水平具有時間依賴性,這些結果表明BMTS的主要成分觸發了BM-MSC與CF基質的黏附,并為增殖和成骨分化提供了充分的條件。
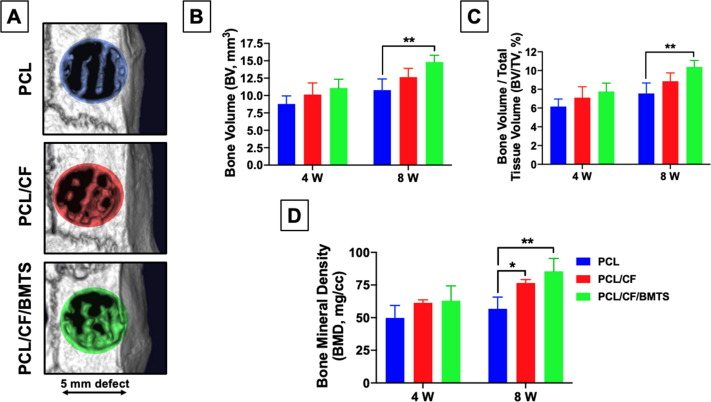
2.3 PCL/CF/BMTS支架植入大鼠顱骨缺損模型后新骨組織形成的體內表征
將PCL/CF/BMTS支架植入含有顱骨缺損的大鼠中評估骨重建效果,表明與PCL組相比,PCL/CF/BMTS組的再生顯著改善(圖6D)。

討論
本研究研發并測評了一種由3D打印的PCL填充BMTS和CF水凝膠組成復合支架,在研發初期,團隊利用了RayBio?人類高通量抗體芯片(AAH-BLG-2000)在骨骼、脂肪和皮膚等多種組織提取的BMTS中挑選了含有利于骨骼修復細胞因子的骨髓間充質干細胞(BM-MSCs)來源的BMTS,使得該支架在保證機械支撐及物理應力的情況下還可以再生所需的骨組織靶向生物大分子,增強了缺損部位的細胞行為和骨愈合。該材料在小鼠顱骨模型的體內修復實驗中也可增強骨素傳導和組織修復,在組織工程應用中有廣闊前景。



 RayBio資訊
RayBio資訊