RayBiotech人細胞因子抗體芯片助力乳腺癌治療研究
雜志名稱:Oncogene
影響因子:8.756
文章題目:CCL8 signaling from tumor-associated macrophages activates fibroblasts to adopt a chemoresistance-inducing phenotype
第一作者:Wenfeng Zeng
通訊作者:Di Huang
作者單位:Guangdong Provincial Key Laboratory of Malignant Tumor Epigenetics and Gene Regulation, Medical Research Center, Sun Yat-Sen Memorial Hospital, Sun Yat-Sen University, Guangzhou, China; Breast Tumor Center, Sun Yat-Sen University, Guangzhou, China; Bioland Laboratory, Guangzhou, China
本實驗所用產品:人腫瘤微環境抗體芯片 (AAH-CYT-5,80個細胞因子)
實驗樣品類型:條件培養基
研究摘要
腫瘤相關成纖維細胞大量存在于多種惡性腫瘤的基質中,已被證明促進腫瘤進展。然而,在臨床和小鼠胰腺癌模型中發現,非選擇性消除癌相關成纖維細胞(CAFs)會導致疾病加重,這表明成纖維細胞在腫瘤微環境中的功能異質性確實很顯著。因此,有必要通過特異性表面標記物識別功能性CAF亞群,揭示其潛在的激活機制,為開發針對特異性CAF亞群的精確抗癌治療鋪平道路。
1
研究結果
1.1 RayBio抗體芯片探索腫瘤微環境關鍵蛋白
為研究誘導化療耐藥的CD10+GPR77+CAF亞群是否來源于正常乳腺組織,研究團隊從正常乳腺組織中分離出不同類型的細胞,然后用新鮮乳腺癌組織的條件培養基(CM)處理。根據新輔助治療的治療反應分為化療敏感組和化療耐藥組,發現化療耐藥患者的活檢樣本中CD10+GPR77+CAFs多于化療敏感患者(圖1A)。為了確定激活誘導化療耐藥的細胞因子,研究人員使用RayBio人腫瘤微環境抗體芯片分析了化療敏感乳腺癌和化療耐藥乳腺癌的腫瘤CM的細胞因子譜(圖1D)。結果發現,在CD10+GPR77+CAFs豐富的化療耐藥腫瘤樣本中,IL-6、IL-8和CCL18三種細胞因子表達豐富(圖1E)。隨后,研究人員發現阻斷CCL18顯著抑制了暴露于化療耐藥腫瘤CM的NBFs中CD10和GPR77的上調(圖1F)。這些數據表明,來自腫瘤CM的CCL18可能介導了誘導化療耐藥的成纖維細胞的激活。
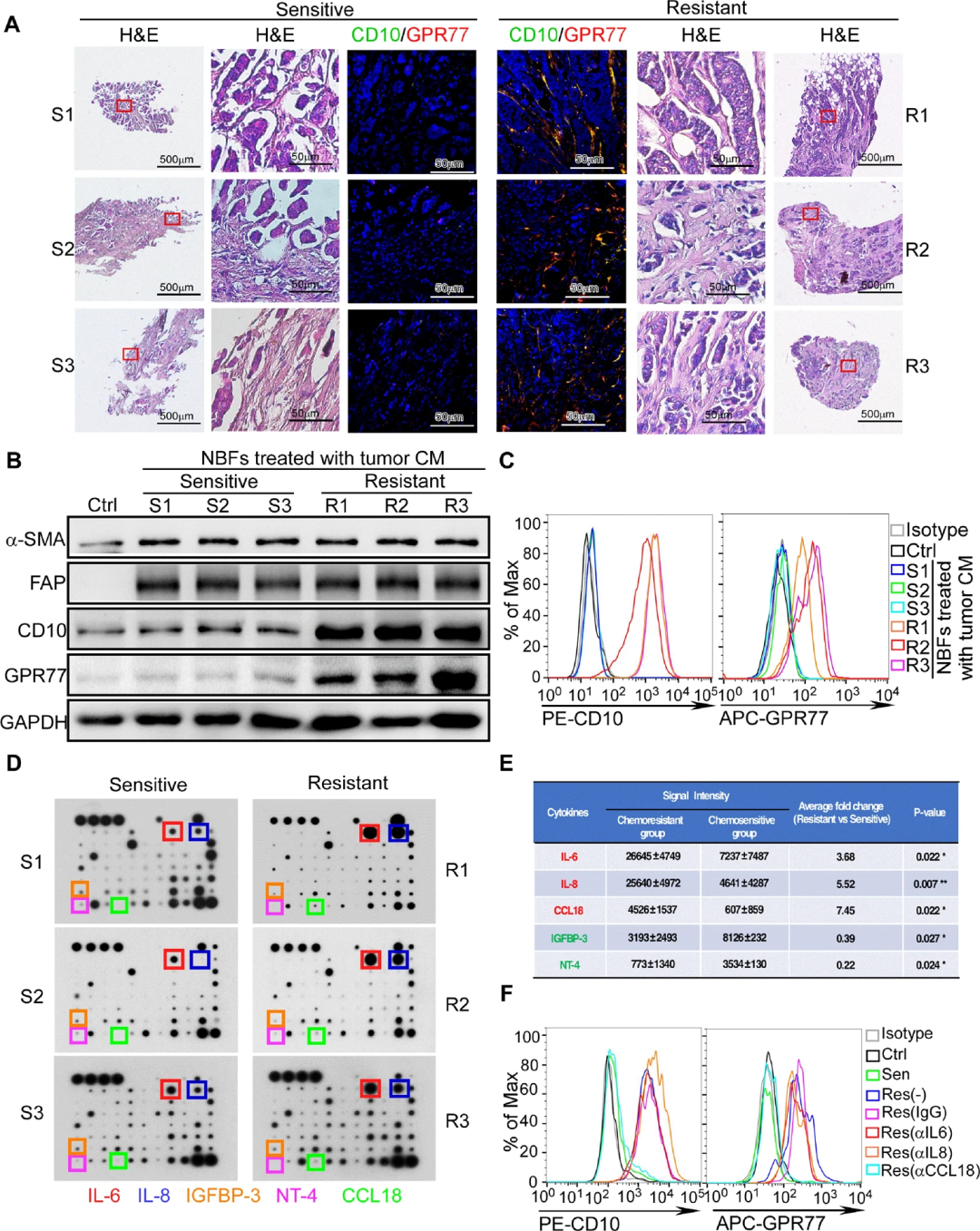
1.2 腫瘤內CCL18+腫瘤相關巨噬細胞的積累與CD10+GPR77+CAFs的豐度和化療耐藥相關
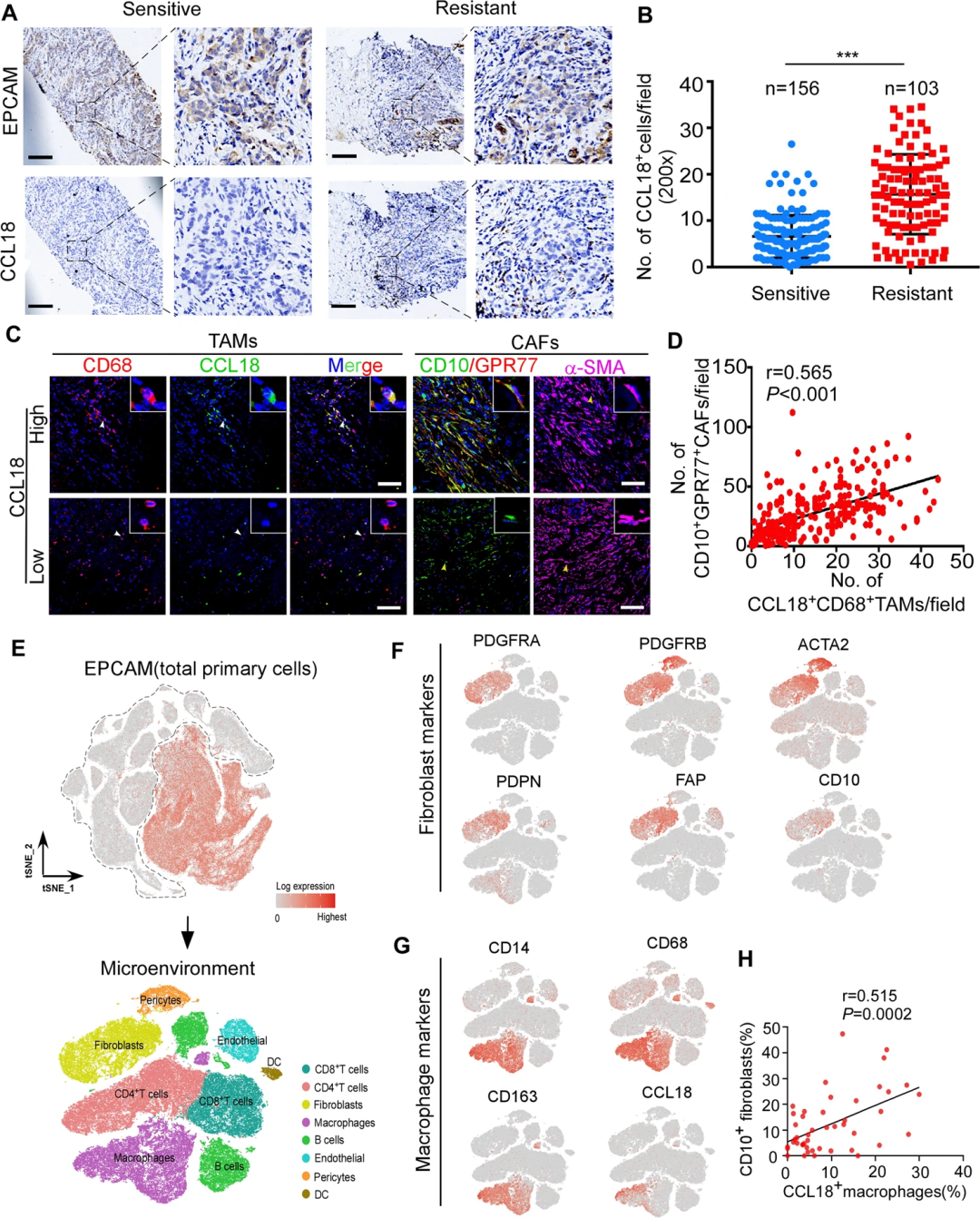
為進一步驗證細胞因子抗體芯片的結果,研究人員對259例乳腺癌患者在新輔助化療前的乳腺腫瘤活檢組織進行了CCL18免疫組化染色,并將CCL18+細胞計數與化療反應相關聯。發現化療耐藥患者(n=103)腫瘤樣本中的CCL18+細胞密度顯著高于敏感患者(n=156)(圖2A,B)。然而,CCL18治療并沒有提高化療下乳腺腫瘤細胞的存活率。隨后,通過對CCL18和巨噬細胞標志物CD68(圖2C)以及CCL18和M2巨噬細胞標志物CD163進行免疫熒光染色。發現CCL18+腫瘤相關巨噬細胞(TAM)的浸潤與CD10+GPR77+CAFs的數量呈正相關(圖2C、D)。
1.3 TAMs產生的CCL18介導了NBF化學耐藥誘導的表型極化
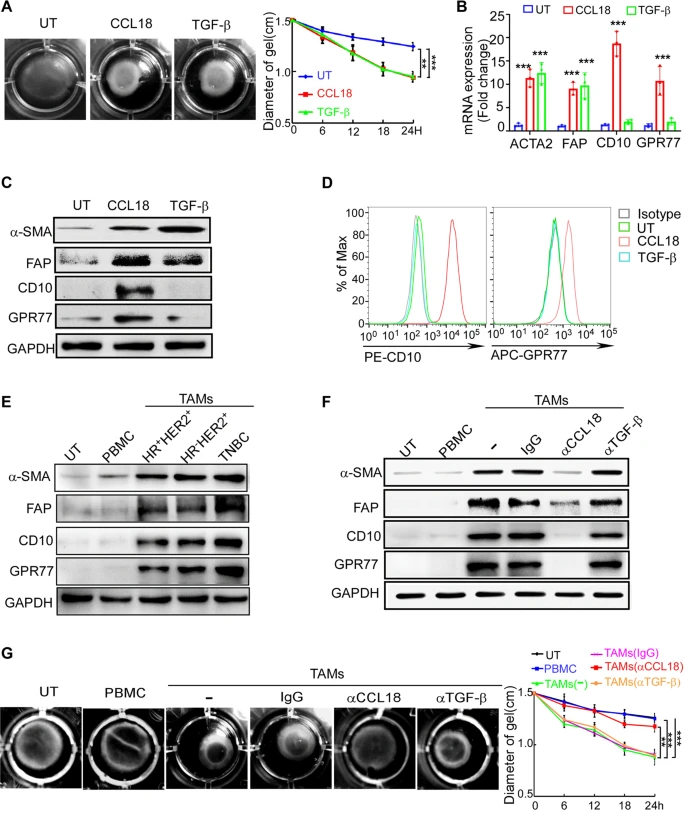
為研究CCL18是否介導腫瘤基質中成纖維細胞的激活,研究人員使用重組CCL18和TGF-β處理從縮乳成形術樣本中分離出來的正常乳腺常駐成纖維細胞(NBFs)。發現CCL18處理增強成纖維細胞介導的膠原收縮的程度與TGF-β相當(圖3A)。此外,CCL18和TGF-β均誘導α-SMA和FAP上調(圖3B、C),但只有CCL18上調CD10和GPR77(圖3B-D)。并且,TAMs誘導的成纖維細胞活化被CCL18的中和抗體顯著抑制(圖3F、G),這表明TAMs通過CCL18激活了NBFs的化學耐藥誘導表型。
1.4 CCL18通過激活NBFs促進乳腺癌腫瘤發生和體內化療耐藥
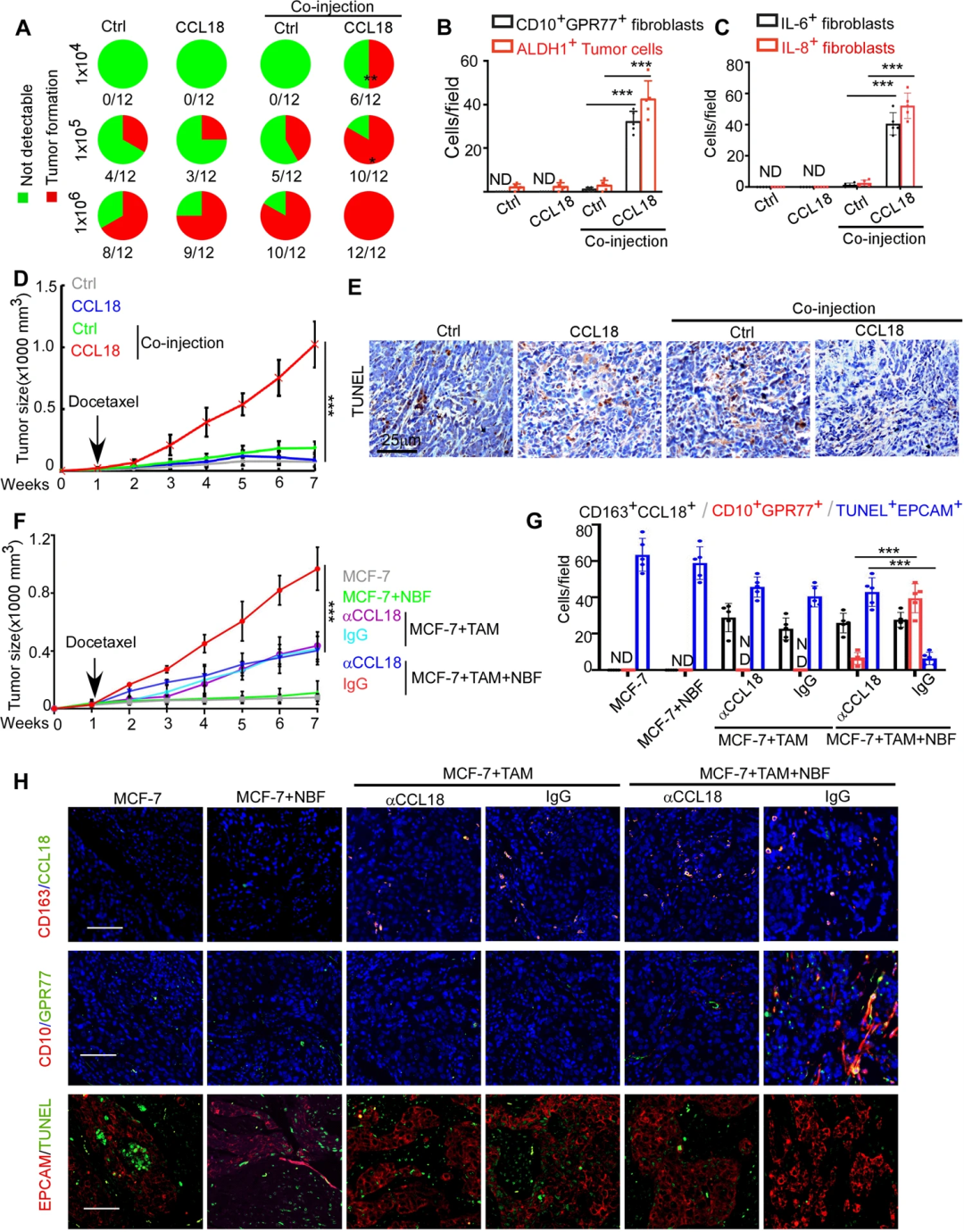
為研究CCL18對NBF激活和體內功能的影響,研究人員將MCF-7細胞接種到NOD/SCID小鼠的乳腺脂肪墊中,隨后對這些小鼠注射重組CCL18,發現CCL18顯著增強了連續移植NBF的MCF-7細胞的致瘤性,但對不含成纖維細胞的乳腺癌異種移植物的致瘤性沒有影響(圖6A)。
研究j結論
本研究中,作者利用RayBio人腫瘤微環境抗體芯片 (AAH-CYT-5)檢測了化療敏感乳腺癌和化療耐藥乳腺癌的腫瘤CM的細胞因子表達,發現IL-6、IL-8和CCL18在CD10+GPR77+CAFs豐富的化療耐藥腫瘤樣本表達豐富。隨后通過一系列的實驗揭示了TAM和成纖維細胞之間的信號串擾是CD10+GPR77+CAF形成的原因,為阻斷特定CAF亞型激活和腫瘤化療耐藥提供了一種潛在的治療靶點。



 RayBio資訊
RayBio資訊