RayBiotech抗體芯片在CAFs與腫瘤耐藥性研究中的應用
雜志名稱:Cell
文獻題目:CD10+GPR77+ Cancer-Associated FibroblastsPromote Cancer Formation and Chemoresistance by Sustaining Cancer Stemness
第一作者:ErweiSong
?
作者單位:Guangdong Provincial Key Laboratory of Malignant Tumor Epigenetics and Gene Regulation, Medical Research Center, Sun Yat-Sen Memorial Hospital, Sun Yat-Sen University, Guangzhou 510120, China
?
本實驗所用產品:RayBiotech人AAH-CYT-5抗體芯片(80個細胞因子抗體芯片)
實驗樣品:胸腺癌患者腫瘤組織
?
研究背景:
腫瘤干細胞(CSCs)是對腫瘤形成和腫瘤耐藥性起到重要作用的細胞群,但未有對其的標記物。腫瘤相關成纖維細胞(CAFs)是許多惡性腫瘤(如胸腺癌/肺癌等)共有的癌細胞,許多研究表明CAFs在腫瘤形成和惡化過程中對腫瘤干細胞(CSCs)有影響,但由于CAFs有許多不同的亞群,各自分泌不同的細胞因子,無法判斷出是哪一類CAF作用于CSCs。本文旨在探究是哪一類CAFs亞群分泌了哪些蛋白分子影響CSCs,使其對化療藥物產生抗性,促使癌癥發展。
?
![]()
?
1 結果
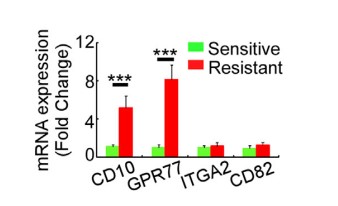
1.1?驗證在胸腺癌和肺癌患者中發現的一種高表達CD10和GPR77的CAF細胞亞群與腫瘤耐藥性和低存活的相關性
? ??為了探究是哪一種CAFs亞群影響腫瘤耐藥性和低存活,收集了578位化療前后的胸腺癌患者的組織樣品,分離出CAF同癌細胞共培養,發現耐藥性癌組織中CAF對癌細胞有影響。采用mRNA芯片檢測mRNA表達量,發現CD10和GPR77基因表達量上調,流式免疫熒光染色,表明CD10和GPR77蛋白在耐藥性腫瘤組織CAF中的表達。
?
?
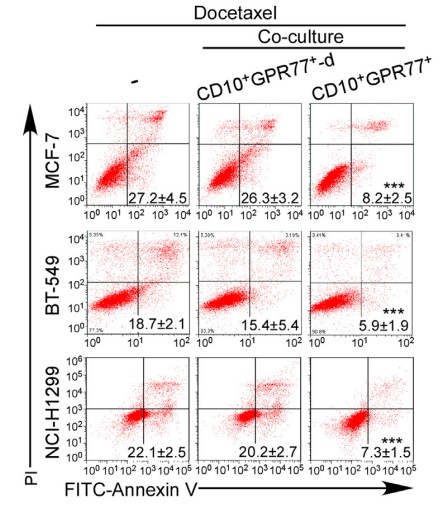
1.2?驗證CD10+GPR77+CAF誘導癌細胞耐受和自身耐受
????為探究高表達CD10和GPR77的CAF亞群是否通過誘導細胞耐受影響癌細胞,收集CD10+GPR77+ CAF,同抑制藥物處理的癌細胞共培養,發現CD10+GPR77+ CAF有效維持了癌細胞系和原代癌細胞的存活。
????為更明顯的說明誘導效果,注射癌細胞到免疫功能不全的小鼠乳腺中,建立移植瘤小鼠模型。發現CD10+GPR77+ CAF不止自身抵抗化療,還能誘導腫瘤細胞在其CAF微環境影響下耐受。
?
 ???
??? ?????
?????
?
?
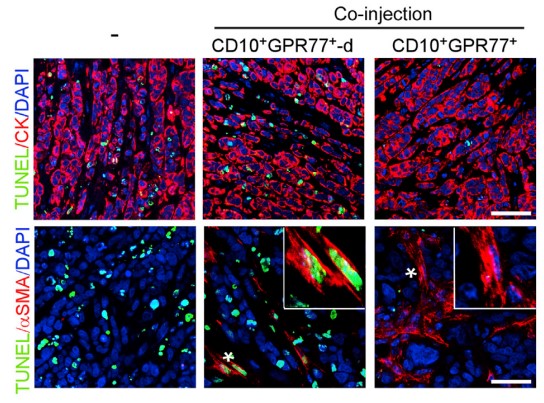
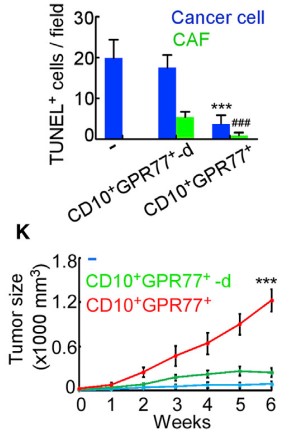
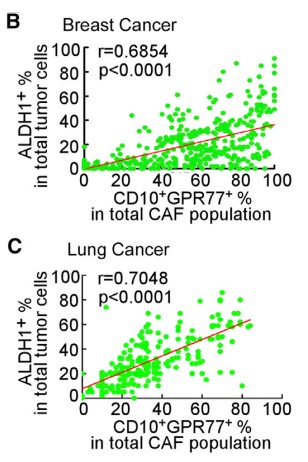
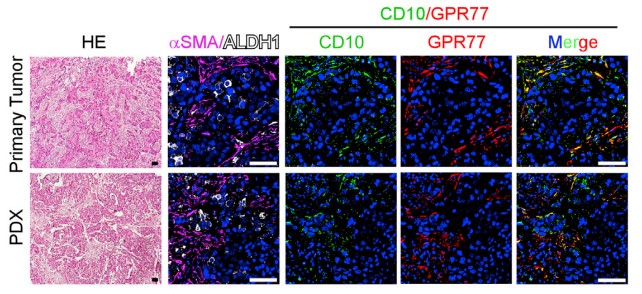
1.3?驗證CD10+GPR77+CAF組成CSCs 的Supporting Niche(微環境)
????由于在胸腺癌耐藥性樣本中發現ALDH1+ CSCs的比例升高,進行臨床胸腺癌CSCs和CD10+GPR77 CAF的相關性實驗,在ALDH1+CSCs中發現CD10+GPR77+ CAF,建立派生瘤模型(PDX),進一步探究在移植瘤模型中CD10+GPR77+CAF是否有助于腫瘤形成的能力,發現了胸腺癌基質中的CD10+GPR77+CAFs有助于PDX的建模和通過CSC增殖形成腫瘤的能力。
?
??? ??????
??????
?
?
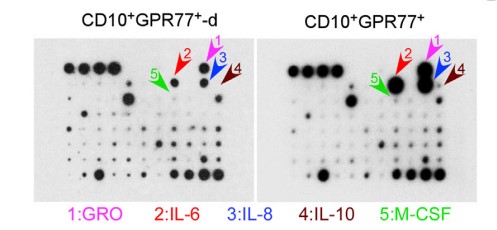
1.4?驗證CD10+GPR77+CAFs通過分泌白介6(IL6)和白介素8(IL8)誘導CSCs增殖
? ? ? ??為探究CD10+GPR77+ CAFs的作用機制,使用人類蛋白抗體芯片檢測了CD10+GPR77+CAFs分泌的蛋白因子,通過蛋白板檢測CD10+GPR77+CAFs分泌蛋白,發現了IL-6 和 IL-8蛋白量在CD10+GPR77+CAF明顯增多,說明CD10+GPR77+ CAF通過分泌IL-6 和 IL-8,促進CSC增殖和腫瘤派生轉移,誘導腫瘤耐受性,分別進行沉默IL-8基因和IL6基因,發現CD10+GPR77+CAFs產生IL-8,IL-8依賴于IL6調控。
 ??????
??????
?
?
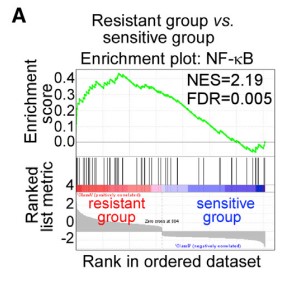
1.5?驗證通過P300調控P65乙酰化延遲NF-kB激活,以維持CD10+GPR77+CAFs的表型和功能
? ? ? ??為解釋CD10+GPR77+CAFs持續產生IL6和IL8激活信號通路的機制,進行了富集分析GSEA(gene set enrichment analysis)、WB(Western Blotting)發現在CAFs中,通過p65磷酸化(S536)和乙酰化(K310)維持 NF-kB的活化,同時也需要其他分子信號(如IKK活化)參與。免疫沉淀反應發現p65與p300的相互作用影響其在K310的乙酰化。
 ??
??
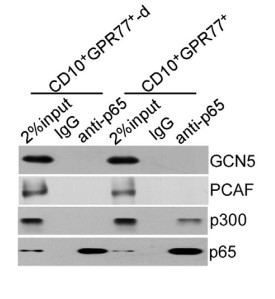
?
?
1.6?驗證在CD10+GPR77+CAFs中,GPR77誘導P65磷酸化是p65乙酰化和參與NF-kB活化的前提
? ? ? ??進一步探究CD10和GPR77 蛋白是否在CD10+GPR77+CAFs中參與信號通路和維持細胞功能。敲除GPR77基因,發現IL6和IL8分泌明顯減少,NF-kB活化受到抑制,p65蛋白減少。沉默GPR77完全抑制RSK1的表達,對IKK沒有明顯影響。說明GPR77誘導P65磷酸化是p65乙酰化和參與NF-kB活化的前提。在MCF-7共培養胸腺癌細胞中,沉默GPR77可終止CD10+GPR77+ CAFs促進CSC增殖和耐藥性的能力。由于GPR77是C5a補體的受體,進一步探究CAF自身是否產生維持GPR77信號表達的補體。發現在CD10+GPR77+CAFs產生較多C5a補體。(6J/6K)且NF-kB調控C5a產生。
?????????????????
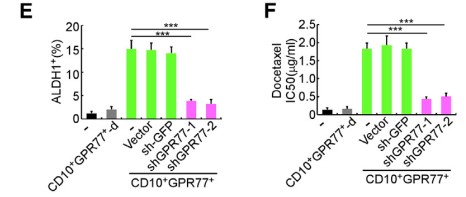

?
?
1.7?抗GPR77腫瘤抑制劑和提高化療效果治療胸腺癌派生瘤模型



 RayBio資訊
RayBio資訊