RayBiotech抗體芯片在腫瘤轉移發生機制研究中的應用
雜志名稱:Nature Communications
文獻題目:OuzounovaM, Lee E, Piranlioglu R, et al. Monocytic and granulocytic myeloid derivedsuppressor cells differentially regulate spatiotemporal tumour plasticityduring metastatic cascade[J]. Nature communications, 2017, 8: 14979.
第一作者:Maria Ouzounova
作者單位:Department of Biochemistry and Molecular Biology, Georgia CancerCenter, Augusta University, Augusta, Georgia 30912, USA.
本實驗所用產品:AAM-CYT-C1000(96個細胞因子抗體芯片)
實驗樣品:細胞培養上清
研究背景:
臨床前和臨床環境的研究證據表明,惡性細胞轉移是一個早期的過程。大多數轉移的細胞在循環中被清除或在包括骨髓在內的遠處器官中保持休眠,而極少數細胞最終發展成功的轉移。因此,細胞成功轉移的機制至關重要。一些器官比其他器官更有利于傳播腫瘤細胞“種子'”生長,成功的轉移需要發展成惡性細胞并消除抗腫瘤應答,一小部分(轉移)細胞?的“種植” - 經歷上皮 - 間質轉化(EMT)與癌癥干細胞(CSC)表型發生,在遠處器官中的成功定植需要通過間充質 - 上皮細胞轉化(MET)使轉移的腫瘤恢復到上皮表型以促進腫瘤細胞增殖。此外,EMT和MET狀態之間的動態和可逆轉變已被證明是驅動鱗狀細胞癌轉移的關鍵過程。與此相一致的是,單獨的EMT標記不能預測大多數惡性腫瘤的轉移,新的證據表明腫瘤浸潤的免疫細胞(主要來源于骨髓)分化成促進腫瘤生長和侵襲的細胞,?MDSCs是包含單核細胞(mMDSC)和粒細胞(gMDSC)亞群的未成熟骨髓細胞的異質群體,兩者都顯示出免疫抑制。?MDSCs在腫瘤轉移機制機制尚未明確,而研究之間的關系對研究腫瘤轉移機制有重要意義。
1 結果
1.1?分組
非轉移性乳腺癌細胞67NR、EMT6上清
轉移性乳腺癌細胞4T1上清
1.2?小鼠乳腺腫瘤在動物模型中的表征
為了研究免疫系統在轉移過程中的作用,我們在同基因(BALB/ c)小鼠異種移植模型中使用轉移性(4T1)和較少侵入性(EMT6)的鼠乳腺細胞系。首先證實了EMT6和4T1腫瘤的致瘤性和轉移能力,當兩個細胞的50,000個細胞注射到乳房脂肪墊中時,它們在8周內產生相似大小的腫瘤(圖1a)。然而,4T1腫瘤早在植入后1周就表現出肺浸潤,并在100%動物中出現自發轉移5周(圖1b),脾臟尺寸和重量也增大(圖1c,d)。為了確定4T1鼠腫瘤的轉移能力是否表現出上皮 - 間質轉化(EMT)表型并且具有癌癥干細胞(CSC)特性,使用如前所述的CD29和CD24抗體對鼠乳腺干細胞標記。免疫熒光染色和流式細胞儀分析顯示,在無血清培養條件下,4T1細胞與EMT6細胞相比顯示更高的Vimentin表達,并且通過CD29 + CD24 +表型評估顯示有更高比例的CSC。
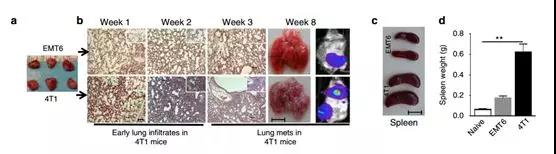
為了確定4T1鼠腫瘤細胞是否也分泌更高水平的炎癥細胞因子,使用RayBiotech細胞因子抗體芯片,其證明與非轉移性EMT6或67NR細胞相比,轉移性4T1腫瘤細胞分泌更高水平的炎癥細胞因子,包括IL6,IL8,RANTES,G-CSF,GM-CSF,IL12,CXCL16,CXCL5和VCAM的趨化因子(圖1e,f)。先前的研究表明,SOCS3負向調節炎癥細胞因子,與這些數據一致。與67NR和EMT6細胞相比,4T1細胞表達更低水平的SOCS3蛋白,并且可以解釋4T1細胞中更高的細胞因子產生的現象。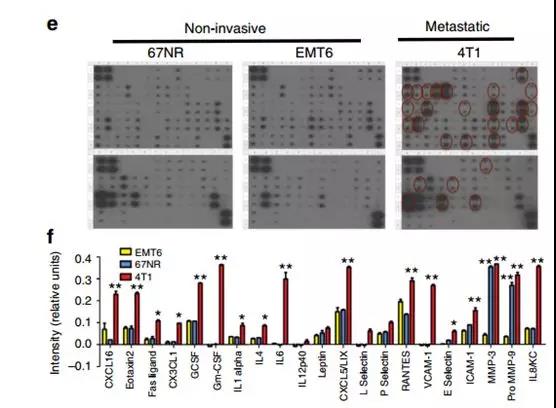
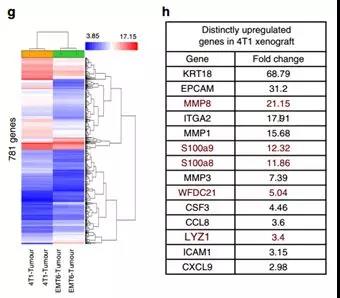
盡管在功能性小鼠移植研究中4T1腫瘤與EMT6相比的轉移性質已得到確認,但是缺乏詳細的比較性基因表達分析。因此,進行小鼠轉錄組分析,結果表明4T1與EMT6異種移植物之間差異表達有781個基因(圖1g)。其中涉及轉移的基因,在4T1腫瘤中以較高水平表達。
1.3?轉移性腫瘤對MDSCs的誘導和浸潤? ? ??
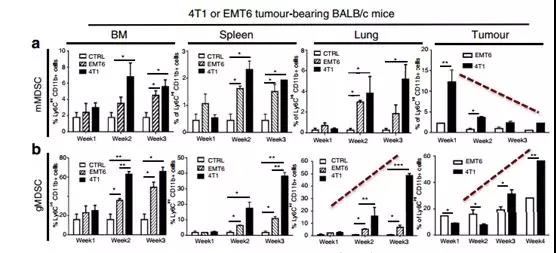
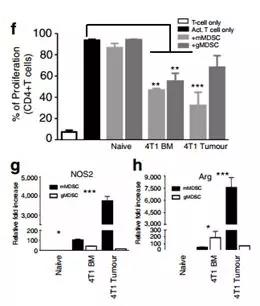
MDSCs是具有兩個主要亞群的不成熟的髓細胞群體,mMDSC和gMDSC。然而,這些腫瘤中MDSC亞群的身份及其與腫瘤相互作用的分子機制仍然難以捉摸。研究人員在EMT6或4T1腫瘤植入后1-4周研究了在原發性腫瘤,骨髓,脾和肺中的mMDSC和gMDSC的系統性誘導和浸潤。結果證明在4T1腫瘤中檢測到早期浸潤(早至1周)的原發性腫瘤中的mMDSCs,并在第4周時逐漸增加gMDSC(圖2a,b)。雖然與攜帶4T1腫瘤的小鼠的原發性腫瘤浸潤相比,肺部mMDSC浸潤較低,但在檢測肺部轉移性病變之前,第3周肺部gMDSC浸潤增加了410倍(圖2a,b)(圖1b )。腫瘤衍生的mMDSCs在體外表現出較高水平的T細胞抑制,這可能是由于較高水平的一氧化氮合酶(NOS2)和精氨酸酶1(ARG1;圖2g,h)造成的。這些發現表明,mMDSCs和gMDSCs分別在原發腫瘤和肺中浸潤,除了抑制抗腫瘤免疫應答外,還能促進轉移。
1.4?用mMDSC誘導EMT / CSC
為了研究MDSC子集對腫瘤的影響,將mMDSC和gMDSC子集從含有4T1腫瘤的動物的骨髓中獨立地流動分選,并且與弱轉移性EMT6細胞共培養。mMDSCs對腫瘤細胞表現出強親和力并誘導EMT表型(圖3b-e)。相反,gMDSCs不能誘導EMT標志物的表達(圖3b-e)。Vimentin和Twist的表達只有來自攜帶4T1荷瘤小鼠的mMDSCs(圖3f-紅色條)與來自EMT6荷瘤動物的mMDSCs(圖3f-黃色條)相比才上調。
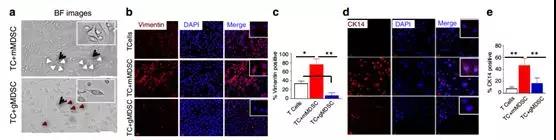

EMT標志物的表達增加與腫瘤細胞的侵襲性增強相關。與此相一致的是,與mMDSCs共培養時EMT6細胞的侵襲增強,而gMDSCs適度(不顯著)抑制了這一過程(圖3g,h)。研究者接下來推測,mMDSC誘導EMT是否也導致了CSC數量的擴大。將EMT6細胞與來自4T1腫瘤生長的小鼠的mMDSC共培養。通過CD24 + CD29 +表型評估,EMT6細胞含有一小部分(41%)的CSC群體,但是當與mMDSC共培養時,CSC數量的擴增超過三倍,而與gMDSCs共培養對CSC水平沒有影響(圖3i)。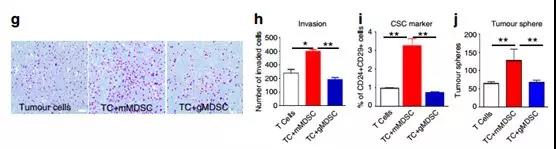
1.5?由mMDSC產生的NOS2誘導腫瘤EMT / CSC表型出現
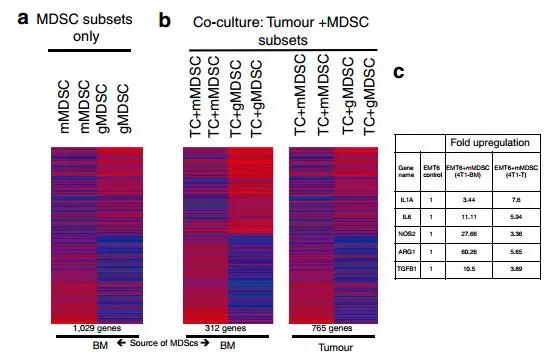
為了確定MDSC誘導的全局基因表達譜,我們進行了小鼠轉錄組分析。在植入后1周從原發性腫瘤和4T1荷瘤小鼠的BM獲得的MDSC利用Ly6C和CD11b表面抗體進行流式分選。結果顯示來自BM或腫瘤的mMDSC和gMDSC亞型顯示出不同的基因表達譜,具有超過1,000個差異表達基因。此外,mMDSC顯示許多EMT相關基因如IL1a,IL6,TGFB1和NOS2的表達升高。相比之下,gMDSC顯示不同組的基因如S100A8,S100A9,MMP8和TGFb3的表達(圖4a)。當與mMDSC或gMDSCs共培養時,數百個基因在EMT6腫瘤細胞中不同地表達(圖4b)。與mMDSC共同培養的腫瘤細胞顯示EMT相關基因的上調超過兩倍(圖4b,c)。
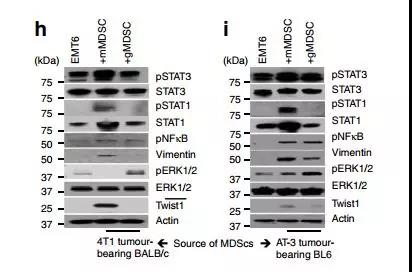
為了確定MDSC亞群對主要信號傳導途徑的影響,在與mMDSCs或gMDSCs共同培養過夜后,對腫瘤細胞裂解物進行western試驗。數據進行基因表達分析,顯示MDSC亞群對腫瘤細胞具有不同的作用。如在4T1 / BALB/ c和AT-3 / C57BL / 6J腫瘤模型中所示,mMDSC誘導pStat1,pStat3和pNF-kB的強上調以及增強的波形蛋白和扭曲在腫瘤細胞中的表達,同時抑制pERK1 / 2活動(圖4h,我)。相比之下,gMDSCs顯示出增強的pERK1 / 2活性,而對pStat1和pStat3活化沒有影響(圖4h,i)。
接下來試圖確定升高的NOS2水平是否在腫瘤細胞中誘導EMT / CSC表型。用NOS2供體,DPTA處理EMT6細胞誘導所示基因的表達,?IL1A,IL6,TGFB1和VIM以劑量依賴性方式通過qPCR分析確定(圖5a)。與這些發現一致,NOS2抑制劑1400W能夠抑制mMDSC誘導的這些基因的轉錄(圖5b)。期望的是,DPTA激活NOS2誘導了pStat1和pStat3信號通路的激活以及EMT標志物,波形蛋白水平,而NOS2抑制劑1400W抑制了后者途徑和EMT標志物的激活(圖5c)。為了評估NOS2介導的EMT相關基因誘導表達,我們在存在和不存在NOS2供體DPTA的情況下進行體外腫瘤侵襲能力測試。用DPTA處理腫瘤細胞引起腫瘤細胞轉移增加,然而,通過1400 W阻斷NOS2,抑制了mMDSC介導的腫瘤細胞侵襲。相同的是,NOS2激活也擴大了CSC數量,而NOS2阻斷減少了mMDSC誘導的CSC細胞數量。總之,這些數據表明,mMDSCs可能通過誘導NOS2產生發揮其對腫瘤細胞的作用。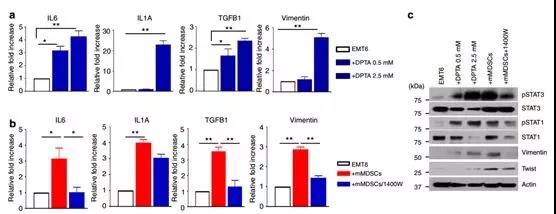
1.6?G-MDSC促進原發性和播散性腫瘤細胞生長
接下來在體外共培養條件下檢查MDSC亞群對腫瘤細胞生長的影響。由于4T1腫瘤在100%的動物中發生自發的肺轉移并且在植入后3周顯示肺中的gMDSC滲透,所以我們推斷肺浸潤的gMDSC可能支持轉移性生長。為了檢驗這個假設,將EMT6腫瘤細胞與來自骨髓(BM),攜帶4T1腫瘤的小鼠的腫瘤或肺的mMDSC或gMDSC共培養。而來源于肺(60%)或腫瘤(40%)的gMDSCs增強腫瘤細胞增殖,相反,骨髓來源的mMDSC或gMDSCs卻沒有這樣做(圖6a,b)。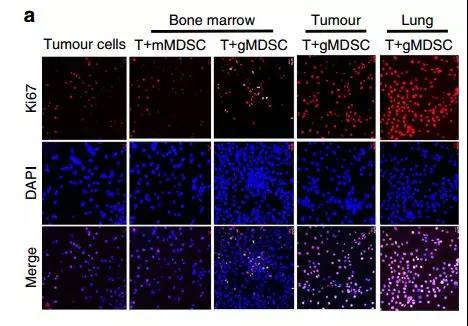
進一步證實,攜帶4T1荷瘤小鼠的肺源性gMDSCs比EMT6荷瘤小鼠的gMDSCs更有效促進腫瘤細胞增殖。
結論:
目前的研究表明,在遠端器官中的成功定植需要具有EMT表型的轉移性腫瘤細胞通過MET恢復至上皮表型。MDSC是未成熟的骨髓細胞,包括單核細胞和粒細胞亞群,兩者都顯示出免疫抑制。盡管大多數研究并沒有區分這兩個亞群,本研究提供了第一個證據,即單核細胞和粒細胞亞群不僅具有獨特的分子特性,而且對腫瘤細胞也有相反的作用。mMDSCs對腫瘤細胞的強烈親和力導致通過上調EMT基因表達誘導EMT / CSC表型,而gMDSC誘導與增殖信號相關的因子的上調。通過mMDSCs在腫瘤細胞中激活Stat1和Stat3信號傳導途徑可以解釋EMT / CSC表型的誘導表達的現象。本研究初步研究MDSCs在腫瘤轉移機制,對研究腫瘤轉移治療有重要意義,RayBiotech在本研究中起重要作用。



 RayBio資訊
RayBio資訊