RayBio抗體芯片在杜氏肌營養不良癥中研究的應用
雜志名稱:Cellular and Molecular Life Sciences
文獻題目:Lecompte, Sophie, et al. "Skeletal muscle secretome in Duchenne muscular dystrophy: a pivotal anti-inflammatory role of adiponectin."?Cellular and Molecular Life Sciences?74.13 (2017): 2487-2501.
第一作者:S. Lecompte
作者單位:
Endocrinology, Diabetes and Nutrition Unit, Institute?of Experimental and Clinical Research, Catholic University?of Louvain
本實驗所用產品:RayBio人 AAH-CYT-1000抗體芯片(120個細胞因子抗體芯片)
實驗樣品:細胞培養上清
研究背景:
杜氏肌營養不良是一種X染色體隱性遺傳疾病,主要發生于男孩。據統計,全球平均每3500個新生男嬰中就有一人罹患此病。患者在學齡前就會因骨骼肌不斷退化出現肌肉無力或萎縮,導致不便行走。大概在7歲到12歲時,會徹底喪失行走能力,通常到20多歲就會因為心肌、肺肌無力而死亡。針對該病,醫學界尚無有效療法。杜氏肌營養不良,一種危害人們的健康的疾病。肌營養不良蛋白缺陷型肌纖維的收縮會產生嚴重的損傷,并產生肌纖維壞死和再生的循環。這些改變導致慢性炎癥,這是這種疾病的發病機制的關鍵特征。在這種情況下,細胞因子和趨化因子在DMD相關的肌肉炎癥中發揮重要和多樣化的作用。前期研究表明脂聯素(ApN)在骨骼肌上表現出抗炎性質,并減輕mdx小鼠的營養不良表型。在這里,我們研究ApN是否在DMD患者獲得的肌管細胞中保留其抗炎作用。我們通過研究其分泌物和ApN的早期關系來揭開潛在的機制。
????
 ????????
????????
1 分組
細胞培養上清樣本:
DMD組成肌細胞上清(n=4)
對照組成肌細胞上清(n=3)
2 結果
2.1??DMD組及對照組肌小管細胞鑒定
成肌細胞分化為肌管在對照(C)和DMD細胞之間沒有差異,如分化開始后第0,3和11天(即分化前后,中期和晚期階段)。更具體地說,在第11天,成熟肌管在兩組中表現出相同的特征性。同樣,在分化過程中,在C和DMD細胞中,肌原性標記的基因表達也相似地增加。

2.2?DMD組及對照組自身的脂聯素表達
我們檢測了基礎狀態下ApN的生產。與對照組相比,營養不良肌管的ApN mRNA和蛋白表達分別下降約60%?15%。?這暗示了DMD肌管中ApN的潛在缺陷,并支持推薦肌營養不良中ApN補充的理論。
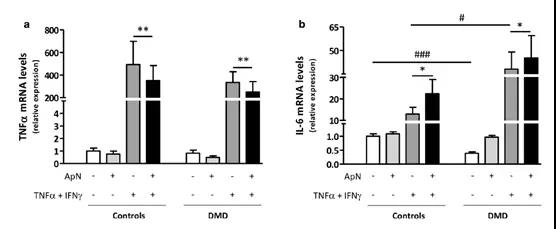
2.3?脂聯素在人類對照和DMD肌管中的抗炎特性
隨后對ApN治療是否在營養不良肌肉中保持其抗炎特性進行研究。為了模擬DMD的炎癥微環境,通過炎癥因子(TNFα/IFNγ)對肌管進行了刺激,TNFα在惡化疾病中起著關鍵的致病作用。在C肌管中,TNFα與INFγ結合誘導其自身的基因表達,IL-6的表達被認為是抵抗炎癥狀態的表現。伴隨的ApN治療,TNFα基因表達的下調(?-30%),進一步上調IL-6(?+ 75%)的表達。ApN實際上下調了TNFα mRNA(?-25%),同時進一步上調IL-6mRNA(?+ 20%)。 這些數據表明ApN可能在營養不良的肌肉中保留其抗炎特性。

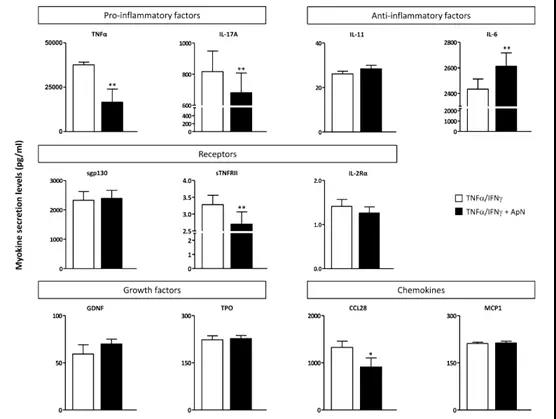
2.4?抗體芯片篩選ApN作用下細胞上清中的差異因子
篩選來自DMD肌管的培養基在或不存在ApN處理的情況下炎癥刺激所引起的變化。在測試的120個細胞因子中,64個由肌管分泌。在ApN存在的情況下,10種蛋白分泌有差異:8種細胞因子低分泌,而另外兩種則分泌過量。這些肌肉蛋白屬于五個家族:促炎因子和抗炎因子/細胞因子,生長因子,可溶性受體和趨化因子。接下來用ELISA定量這些差異因子進行驗證。結果表明,通過ApN處理下調兩種促炎因子(TNFα和IL-17A),一種可溶性受體(sTNFRII)和一種趨化因子(CCL28)的分泌。相反,只有IL-6上調,其可能具有抗炎特性。
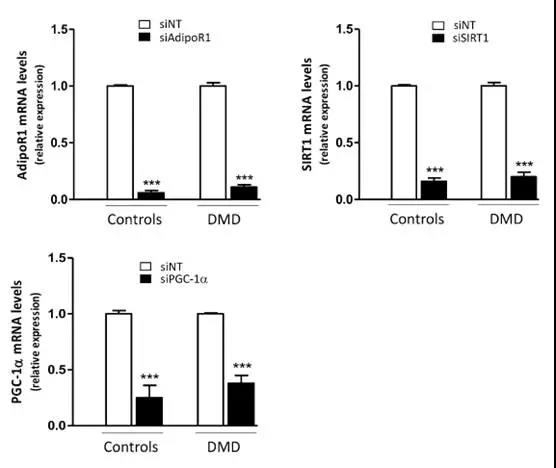
2.5 ?ApN在對照組和DMD肌管中的抗炎作用的機制
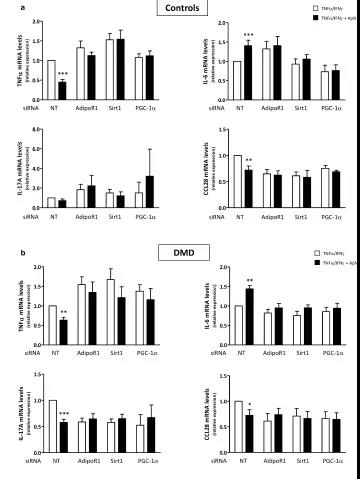
接下來研究連接AdipoR1-SIRT1-PGC-1α的信號通路是否參與了DMD肌管中ApN的抗炎作用。為此,使用特異性siRNA敲除了該途徑的每個組分。首先證實,siRNA沉默是有效的,如靶基因表達的顯著降低(-65至-95%)。接下來,證明在C肌管中,ApN在存在的條件下發揮其抗炎作用:它降低TNFα(?55%)和CCL28(-28%) 同時增加IL-6 mRNA(+ 40%)。
當用針對AdipoR1,SIRT1或PGC-1α的siRNA轉染肌管時,這些變化被消除。因此,AdipoR1-SIRT1-PGC-1α信號通路的每個組分似乎是ApN在C和營養不良肌肉中的抗炎作用所必需的。
結論:
首先,與對照組相比,營養不良肌管的基礎ApN表達和分泌降低。之前的研究已經表明,在急性或慢性炎癥的環境中,ApN在體內被“正常”的小鼠骨骼肌過度產生,以局部抵消過度和有害的炎癥反應。相比之下,mdx小鼠的骨骼肌不能局部過度產生ApN。同樣,這種情況似乎在人類營養不良肌管中也有同樣的表現,與對照相比,ApN表達降低。這表明在DMD肌管中ApN的潛在缺陷,并支持在該病理學中推薦ApN補充的說法。 ApN對肌細胞分泌狀況的影響仍然很大程度上是不明確的。為了研究ApN治療前后DMD肌管的分泌物譜。使用Rybiotech的細胞因子抗體芯片進行檢測并用ELISA方法進行驗證,我們確定了幾種由人類營養不良肌管分泌的肌動蛋白是由ApN調節。這些肌肉蛋白屬于四個家族:抗炎因子/細胞因子,可溶性受體和趨化因子。ApN下調了幾種促炎癥分子(TNFα,IL-17A和CCL28),同時上調IL6,其在免疫應答中起雙重作用。據我們所知,這兩種分子(sTNFRII,CCL28)是人肌管的新型分泌產物。ApN通過AdipoR1和AMPK-SIRT1-PGC-1α途徑介導其對控制肌管的保護,從而導致轉錄因子NF-κB表達下調。總之,ApN通過激活AdipoR1和AMPKSIRT1-PGC-1α途徑在營養不良的肌肉中保持其有益的性質,從而誘導下游肌肉分泌向較少炎癥分布的轉變,同時上調utrophin A、及其下游肌肉ApN,這機制可能成為治療DMD的關鍵點,Raybiotech的抗體芯片在該機制的研究中起重要作用。




 RayBio資訊
RayBio資訊